
胰腺癌是消化系统中恶性程度最高的肿瘤之一,现有治疗方法效果不佳,急需开发新的有效治疗策略。研究显示胰腺癌细胞对葡萄糖和谷氨酰胺高度依赖,具有"成瘾性"。破坏这种葡萄糖和谷氨酰胺成瘾可能成为胰腺癌治疗的潜在策略。人血白蛋白是血浆中含量最丰富的成分之一,人血白蛋白纳米颗粒具有毒性小、稳定性好、易加工等优点,被广泛用作药物载体。代表药物白蛋白结合型紫杉醇已被纳入指南,成为胰腺癌辅助治疗的首选药物。关于葡萄糖饥饿疗法诱导细胞焦亡的报道主要采用葡萄糖氧化酶,但该方法需要氧气的参与,而胰腺癌由于缺乏血液供应和氧气,可能限制了该方法的效果。
近日,哈尔滨医科大学附属第一医院孙备教授团队与中国科学院长春应用化学研究所马平安研究员团队合作开发了一种用于双重抑制葡萄糖和谷氨酰胺摄取诱导胰腺癌细胞焦亡的纳米药物,相关成果发表于《美国化学会志》(journal of the american chemical society,影响因子:15)上,并入选为当期杂志封面文章之一。
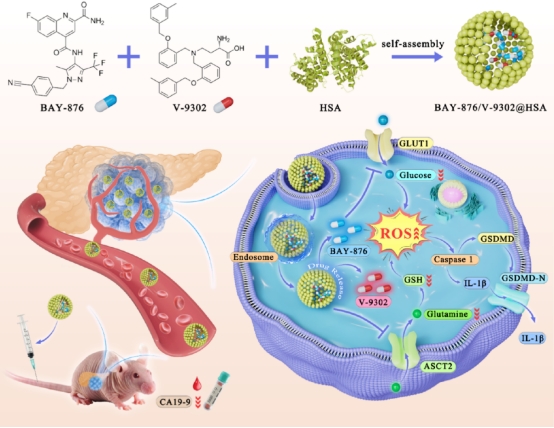
bay-876/v-9302@hsa纳米颗粒的合成及诱导细胞焦亡示意图
该研究首先通过生物信息学分析确定了在胰腺癌中分别调控葡萄糖和谷氨酰胺摄取的重要基因葡萄糖转运蛋白1(glut1)和丙氨酸-丝氨酸-半胱氨酸转运蛋白2(asct2)。随后,利用人血白蛋白纳米颗粒通过自组装策略制备了用于传递glut1和asct2抑制剂的人血白蛋白纳米药物bay-876/v-9302@hsa。该纳米药物通过释放的bay-876和v-9302抑制了胰腺癌细胞的葡萄糖和谷氨酰胺摄取,导致肿瘤细胞营养被剥夺并加重氧化应激。v-9302对谷氨酰胺的抑制导致谷胱甘肽的合成受到抑制,进一步加剧氧化应激。两者通过协同作用导致活性氧显著增加,激活caspase 1和gsdmd,最终诱导胰腺癌细胞焦亡。实验结果显示,bay-876/v-9302@hsa在体外和体内均取得了良好的抗胰腺癌效果,并能降低胰腺癌标志物ca19-9水平。
细胞焦亡是一种程序性细胞死亡方式,其特征是细胞膜形成空洞和细胞膨胀,涉及gasdermin介导的caspase活化和gsdmd切割,导致细胞膜破坏和死亡。与细胞凋亡不同,细胞焦亡能释放damps激活免疫细胞,对免疫原性死亡具有重要意义,为胰腺癌免疫治疗提供新思路。ca19-9是胰腺癌细胞表面高表达的糖蛋白,作为fda批准的胰腺癌诊断标记物,广泛用于胰腺癌的诊断、预后评估和疗效监测。胰腺癌手术后ca19-9水平再次升高通常预示肿瘤复发和不良预后。研究将ca19-9用于评估纳米材料对胰腺癌治疗效果,更贴合临床需求。
总的来说,这项研究开发了一种通过双重饥饿诱导胰腺癌细胞焦亡来有效治疗胰腺癌的纳米药物。同时,该研究还提供了一种有效的构建靶向肿瘤代谢治疗纳米药物的策略。首先,通过生物信息学分析找出代谢靶点以及最佳抑制剂,然后利用巧妙的自组装技术构建纳米药物。这种策略能够为未来设计纳米抗肿瘤药物提供重要启示,也对胰腺癌治疗的进一步发展具有重要意义。
学科交叉作为科技创新的关键动力,正受到国家战略需求的大力推动。在新时代背景下,人工智能、生命科学等前沿科技的深度融合日益显著。孙备教授及其团队长期深耕于学科交叉与医工合作领域,其研究成果已在《chemical engineering journal》、《science advances》等国际顶尖学术期刊上发表。孙备教授强调,在人才培养上,应全面重视医学、教育和研究的协调发展,致力于培育具有创新思维与实践技能的交叉学科人才。通过开展医工结合项目,可以积极推动学科交叉融合,满足高质量发展的人才体系需求,并增强创新人才的自主培养能力。在此过程中,医学生可以学习到工程学的原理和技术,而工科学生可以了解医学知识和临床需求。这种跨学科的知识体系有助于他们更全面地理解科学问题,鼓励学生发展创新思维和解决问题的能力。
上述研究工作得到哈尔滨医科大学生物信息科学与技术学院戚丽霜副教授团队的帮助和支持。