9月9日,哈尔滨医科大学附属第一医院孙备教授团队在国际知名学术期刊《molecular cancer》(中科院1区,if: 37.3)上,在线发表题为“circeif3i facilitates the recruitment of smad3 to early endosomes to promote tgf-β signalling pathway-mediated activation of mmps in pancreatic cancer”的研究成果。哈尔滨医科大学附属第一医院胰胆外科与肝脾外科教育部重点实验室为第一及通讯作者单位,哈尔滨医科大学附属第一医院孙备教授、胡继盛教授为共同通讯作者,哈尔滨医科大学附属第一医院赵忠杰博士,杨文博博士,孔瑞教授为共同第一作者。
该研究发现环状rna“circeif3i”在胰腺癌组织中高表达,并与分期及预后密切相关,并揭示了其可作为一种分子支架与smad3和ap2a1直接结合形成三元复合体,促进smad3向早期内体上的tgfβr1富集,从而激活tgf-β信号通路促进胰腺癌转移的分子机制,为胰腺癌诊治提供了新的理论依据和潜在的治疗靶标。

胰腺癌是恶性程度极高的消化道肿瘤,五年生存率仅为10%。其发病原因错综复杂且起病凶险,8成的胰腺癌患者发病时就伴有局部进展或远处转移,从而错失手术根治的机会。因此探究胰腺癌早期诊断的分子标志物及其转移的分子机制将对胰腺癌诊治大有裨益。环状rna所具有的高度的稳定性、丰度、发展阶段特异性以及组织特异性等特点使其具备了成为合格生物学标志物的潜质,而其进化层面的保守性也提示了circrna具有重要的生物学功能。
研究团队结合胰腺癌测序数据及大量临床样本分析,筛选出在胰腺癌中表达显著高于正常胰腺组织的环状rna——“circeif3i”,并验证其与胰腺癌病人的预后呈现显著的负相关。在明确circeif3i的环状结构后通过一系列的体内体外实验证实了circeif3i能够显著促进了胰腺癌侵袭与转移的能力。
在分子机制层面上的探究,研究团队并未停留在cerna、翻译蛋白等circrna发挥功能的主流分子机制上,而是通过trap、质谱、rna pull-down、co-ip,rna体外环化,fish、分子对接等一系列实验充分明确了circeif3i充当smad3与ap2a1蛋白间的分子支架,促进smad3蛋白向早期内体富集,使得内化的tgfβr1激活smad3,而激活的smad3在核转位后促进mmps的转录最终促进胰腺癌细胞侵袭与迁移。本研究进一步丰富了circrna调控胰腺癌转移的分子机制,也成为本研究的特色和创新之处。
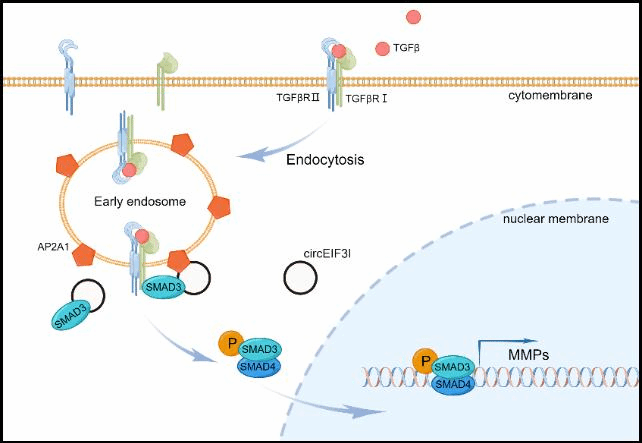
tgf-β信号通路在胰腺癌恶性进展中扮演着双刃剑的角色,在早期胰腺癌中tgf-β信号常常充当抑癌角色,而晚期胰腺癌中则起到促进肿瘤恶性进展。尽管tgf-β信号通路的这一特性已被熟知,其蕴藏的深层分子机制仍有待揭晓。本研究另辟蹊径,从circrna入手阐释了胰腺癌细胞中非经典的tgf-β信号通路活化的分子机制,或可在不久的将来为tgf-β相关药物靶点的设计提供理论依据。
据了解,该研究受到哈尔滨医科大学附属第一医院优秀青年科学基金,哈尔滨医科大学附属第一医院科研创新基金,黑龙江省博士后基金,国家自然科学基金,黑龙江省自然科学基金的资助。团队负责人孙备教授长期致力于胰腺炎以及胰腺癌的临床与基础研究,并先后主持国家自然科学基金、省部级重点科研项目等课题多项。